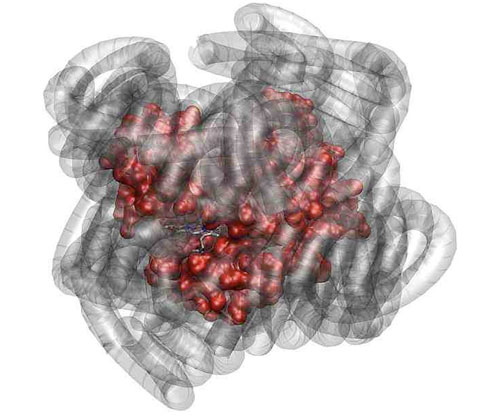
Hierzu hat das internationale Team um Adam Perriman von der University of Bristol in der Hülle eines Myoglobin-Proteins, das normal Sauerstoff zu den Muskeln transportiert und auch rohem Fleisch seine rote Farbe verleiht, Wasser gegen ein synthetisches Polymer ausgetauscht, das als oberflächenaktiver Stoff Proteine in eine dickflüssige Flüssigkeit umwandelt. Damit wirken sie sozusagen als "alternatives Schmiermittel", so dass die Hybride aus dem Muskelprotein Myoglobin und Polymeren reversibel Sauerstoff binden können, ganz so wie das Myoglobin in seiner natürlichen Form.
Die Wissenschaftler aus Großbritannien, Frankreich Australien und Deutschland konnten jetzt die Gründe dafür nachweisen. Neutronenexperimente an Instrumenten des Forschungszentrums Jülich an der Forschungs-Neutronenquelle Heinz Maier-Leibnitz (FRM II) in Garching bei München und an Instrumenten des Institut Laue-Langevin (ILL) im französischen Grenoble machten die Untersuchungen hierzu möglich. Ihre Ergebnisse haben die Forscher aktuell im Fachmagazin Journal of the American Chemical Society veröffentlicht.
Die Forscher entdeckten, dass sich Proteine, die von einer Polymerschicht bedeckt sind, vergleichbar bewegen können wie Proteine, die von einer Schicht Wasser bedeckt sind. Auch ist die Polymerschicht vergleichbar flexibel wie die Wasserschicht. "Das Hydratwasser von Proteinen kann also durch Polymere ausgetauscht werden, ohne dass die Proteine ihre Beweglichkeit und damit ihre Funktionsfähigkeit einbüßen", erläutert Dr. Martin Weik vom Institut de Biologie Structurale in Grenoble.
Die Ergebnisse widerlegen das Dogma von Wasser als wichtigster Grundlage biologischer Moleküle. "Es gibt also Wege, Wasser durch etwas anderes zu ersetzen und dennoch die Funktionalität der Proteine aufrecht zu erhalten", erläutert Mart Weik vom "Institut de Biologie Structurale" in Grenoble. Leben könnte also zumindest hypothetisch auch in wasserlosen Umgebungen entstanden sein. Allerdings: Die nun untersuchten Protein-Polymer-Hybride existieren so nicht in der uns bekannten Natur.
Quellen: frm2.tum.de, ibs.fr



Kommentare von Lesern
für unseren Newsletter an