Die Wissenschaftler der Ludwig-Maximillians-Universität (LMU) in München, der Technischen Universität München (TUM) und des Universitätsklinikums Essen konnten in ihren aktuellen Untersuchungen „die entscheidenden Moleküle und Prozesse“ der Helicobacter-Infektion entschlüsseln und damit neue Therapieoptionen aufzeigen, so die Mitteilung des Deutschen Zentrums für Infektionsforschung (DZIF). Forscher des DZIF waren maßgeblich an beiden Studien beteiligt. Veröffentlicht wurden die Arbeiten in dem Fachmagazin Nature Microbiology“
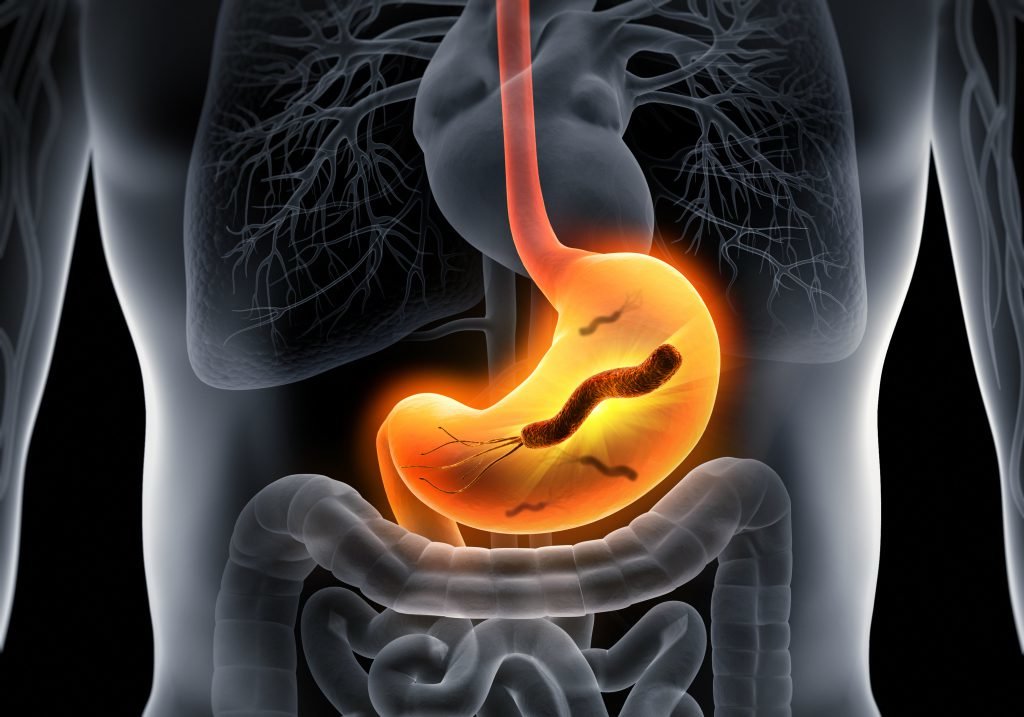
Helicobacter pylori oft Ursache für Magengeschwüre und Magenkrebs
Infektionen mit Helicobacter pylori sind in vielen Fällen Auslöser für die Entwicklung von Magengeschwüren und Magenkrebs. „Die chronische Helicobacter-Infektion der Epithelzellen der Magenschleimhaut gilt als wichtiger Risikofaktor für Magenkrebs“, berichtet das DZIF. Weltweit seien jedes Jahr rund 750.000 neue Magenkrebserkrankungen zu verzeichnen. Welcher Mechanismus bei einer Helicobacter-Infektion die Entwicklung von Magengeschwüren und Magenkrebs fördert, blieb bislang allerdings unklar.
Bislang unbekanntes Molekülpaar entdeckt
Um die Mechanismen der Helicobacter-Infektion besser zu verstehen, untersuchten die Forscher um Prof. Rainer Haas vom Max von Pettenkofer-Institut der LMU, Professor Markus Gerhard vom Institut für Medizinische Mikrobiologie, Immunologie und Hygiene der TUM und Dr. Bernhard B. Singer von der Universität Duisburg-Essen, welche Rezeptoren an der Bindung zwischen Bakterium und Wirtszelle beteiligt sind. Den Forschern gelang es, bislang unbekannte Rezeptoren auf der Oberfläche der Epithelzellen zu identifizieren (sogenannte CEACAMs), an denen die Bakterien andocken. Auch konnten sie den Gegenpart auf bakterieller Seite bestimmen - das Protein HopQ.
Bakterien mit molekularer Giftspritze
Die Forscher fanden außerdem heraus, dass das entdeckte Molekülpaar „nicht nur für die Bindung der Bakterien an ihre Wirtszellen wichtig (ist), sondern auch für die pathogene Wirkung der Bakterien“, so die Mitteilung des DZIF. Eigentlicher Krankheitsauslöser sei das bakterielle Protein CagA, welches von besonders pathogenen H. pylori-Stämmen über einen nadelartigen Fortsatz in die Epithelzellen der Magenschleimhaut injiziert werde. Die „molekulare Giftspritze“ bilde die Basis für die gefürchtete Wirkung der Bakterien. Aktiv werde das molekulare Injektionssystem erst durch die Bindung des bakteriellen Proteins an die Proteine der Epithelzellen.
Neue Möglichkeiten zur Prävention und Therapie?
Auf Basis des entdeckten Mechanismus könnten sich nach Ansicht der Forscher in Zukunft neue Therapieoptionen eröffnen. So geht Prof. Gerhard davon aus, dass das bakterielle Molekül HopQ diagnostisch und therapeutisch nutzbar ist. Mit einer löslichen Variante von HopQ oder Teilen des Proteins ließe sich möglicherweise die Bindung des Bakteriums an die Magenzellen verhindern und somit der Prozess der Krankheitsentstehung aushebeln. „Spezifische Inhibitoren der HopQ-CEACAM-Interaktion könnten eine Infektion entweder komplett verhindern oder die CagA Injektion unterbinden“, betont auch Prof. Haas in einer Pressemitteilung der LMU zu den Forschungsergebnissen.


Kommentar: Wie Helicobacter pylori vorgeht: Magenkeim schädigt Erbgut